I. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn:
+ Các nguyên tố hóa học được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử.
+ Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
+ Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột.
II. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
1. Mô tả cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Bảng tuần hoàn gồm các nguyên tố hóa học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm.
- Các nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng tuần hoàn.
2. Ô nguyên tố
- Trong bảng tuần hoàn, mỗi ô nguyên tố cho biết các thông tin cần thiết về một nguyên tố hóa học.
Chú ý:
- Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân (bằng số proton trong hạt nhân) và bằng số electron của nguyên tử.
- Số hiệu nguyên tử cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Dựa vào ô nguyên tố số 8 trong bảng tuần hoàn ta biết được:
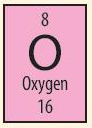
+ Số hiệu nguyên tử: 8
+ Kí hiệu hóa học: O
+ Tên nguyên tố: oxygen
+ Khối lượng nguyên tử: 16 amu
+ Ngoài ra:
Điện tích hạt nhân = +8.
Số đơn vị điện tích hạt nhân = số proton = số electron = 8
3. Chu kì trong bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được sắp xếp vào cùng một hàng ngang trong bảng tuần hoàn được gọi là chu kì.
- Hiện nay, bảng tuần hoàn gồm có 7 chu kì, xét về số lượng các nguyên tố trong mỗi chu kì thì chu kì được chia thành:
+ Chu kì nhỏ gồm các chu kì 1, 2, 3.
+ Chu kì lớn gồm các chu kì 4, 5, 6, 7.
- Số thứ tự chu kì bằng số lớp electron.
4. Nhóm trong bảng tuần hoàn các nguyên tố hóa học
- Nhóm là tập hợp các nguyên tố có tính chất hóa học tương tự nhau và được xếp thành cột, theo chiều tăng dần về điện tích hạt nhân.
Chú ý:
+ Số thứ tự nhóm được kí hiệu bằng các chữ số La Mã.
+ Nhóm IA gồm các nguyên tố kim loại hoạt động mạnh (trừ H).
+ Nhóm VIIA gồm các nguyên tố phi kim hoạt động mạnh (trừ At, Ts).
III. Các nguyên tố kim loại
1. Các nguyên tố kim loại nhóm A
- Các nguyên tố kim loại nhóm A gồm nhóm IA (trừ nguyên tố hydrogen); nhóm IIA, nhóm IIIA (trừ nguyên tố boron), …
- Các nguyên tố kim loại thuộc nhóm IA được gọi là nhóm kim loại kiềm.
- Các nguyên tố kim loại thuộc nhóm IIA được gọi là nhóm kim loại kiềm thổ.
2. Các nguyên tố kim loại nhóm B
- Các nguyên tố nhóm B đều là kim loại, mỗi nhóm B tương ứng với một cột trong bảng tuần hoàn (trừ nhóm VIIIB có 3 cột).
- Một số kim loại nhóm B có ứng dụng rộng rãi trong đời sống hàng ngày như: + Iron: Làm vật liệu xây dựng, đồ dùng trong gia đình như dao, kéo, búa, kệ sắt, cửa sắt, bàn ghế, … Làm khung cho các loại máy móc, phương tiện giao thông, ...

+ Copper: Làm dây dẫn điện, đúc tượng, làm xoong nồi, …

+ Silver: làm đồ trang sức, linh kiện điện tử, sử dụng trong nha khoa để bọc răng, sản xuất các loại thuốc, chất giặt rửa ứng dụng công nghệ nano bạc, …

Chú ý: Hơn 80% các nguyên tố hóa học trong bảng tuần hoàn là kim loại, bao gồm một số nguyên tố nhóm A và tất cả các nguyên tố nhóm B.
IV. Các nguyên tố phi kim
1. Vị trí
- Nhóm nguyên tố phi kim chủ yếu tập trung ở góc bên phải của bảng tuần hoàn các nguyên tố hóa học.
- Các nguyên tố phi kim bao gồm:
+ Nguyên tố hydrogen ở nhóm IA.
+ Một số nguyên tố ở nhóm IIIA và IVA.
+ Hầu hết các nguyên tố thuộc nhóm VA, VIA và VIIA.
2. Tính chất
- Ở điều kiện thường, các phi kim có thể ở thể rắn, thể lỏng hoặc thể khí.
- Nhóm nguyên tố phi kim VIIA được gọi là nhóm nguyên tố halogen. Các đơn chất thuộc nhóm halogen có một số đặc điểm như:
+ Có màu sắc đậm dần từ fluorine tới iodine, thể thay đổi từ khí – lỏng – rắn.
+ Độc hại đối với các sinh vật.
V. Nhóm các nguyên tố khí hiếm
1. Vị trí trong bảng tuần hoàn
- Nhóm VIIIA gồm các nguyên tố khí hiếm: Helium (He); Neon (Ne); Argon (Ar); Krypton (Kr); Xenon (Xe); Radon (Rn) và Oganesson (Og – nguyên tố nhân tạo).
2. Tính chất
Ở điều kiện thường, các nguyên tố khí hiếm có những đặc điểm giống nhau như:
+ Chất khí, không màu, tồn tại trong tự nhiên với hàm lượng thấp.
+ Tồn tại dưới dạng đơn nguyên tử.
+ Các nguyên tố của nhóm khí hiếm rất kém hoạt động, hầu như không phản ứng với nhau và với chất khác.
3. Ứng dụng
- Các nguyên tố khí hiếm chiếm tỉ lệ thể tích rất ít trong không khí nhưng có những ứng dụng quan trọng trong đời sống.
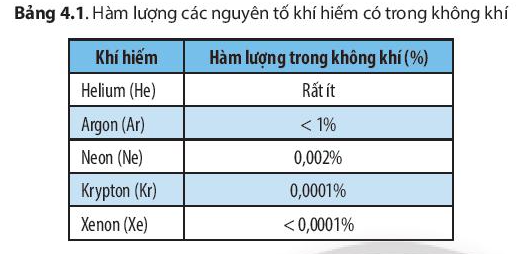
- Khí hiếm được ứng dụng nhiều nhất trong công nghệ chế tạo bóng đèn. Các bóng đèn chứa xenon, argon và neon có thể phát ra ánh sáng với các màu sắc khác nhau.

- Xenon được sử dụng làm khí gây mê toàn phần; ứng dụng trong năng lượng hạt nhân; là tác nhân oxi hóa trong hóa học phân tích; ứng dụng trong tinh thể học protein.
BÀI VIẾT LIÊN QUAN (Giải SGK):
Chủ đề 1. Nguyên tử - Nguyên tố hóa học - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
3. Bài 4. Sơ lược bảng tuần hoàn các nguyên tố hóa học
Chủ đề 2. Phân tử
1. Bài 5. Phân tử - Đơn chất - Hợp chất
2. Bài 6. Giới thiệu về liên kết hóa học
3. Bài 7. Hóa trị và công thức hóa học
Chủ đề 1. Nguyên tử - Nguyên tố hóa học - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
3. Bài 4. Sơ lược bảng tuần hoàn các nguyên tố hóa học
Chủ đề 2. Phân tử
1. Bài 5. Phân tử - Đơn chất - Hợp chất








0 Comments:
Đăng nhận xét