1. MÔ HÌNH NGUYÊN TỬ RUTHERFORD – BOHR
Câu 1 trang 14 SGK Khoa học tự nhiên 7 CTST
Những đối tượng nào trong Hình 2.1 ta có thể quan sát bằng mắt thường? Bằng kính lúp? Bằng kính hiển vi?

Trả lời:
Những đối tượng có thể quan sát bằng mắt thường: Ruột bút chì.
Những đối tượng có thể quan sát bằng kính lúp: Hạt bụi trong không khí.
Những đối tượng có thể quan sát bằng kính hiển vi: Tế bào máu, vi khuẩn.
Câu 2 trang 14 SGK Khoa học tự nhiên 7 CTST
Quan sát Hình 2.2, em hãy cho biết khí oxygen, sắt, than chì có đặc điểm chung gì về cấu tạo?

Trả lời:
Đặc điểm chung về cấu tạo của khí oxygen, sắt, than chì là: đều được tạo nên từ những hạt vô cùng nhỏ và liên kết với nhau.
Câu 3 trang 15 SGK Khoa học tự nhiên 7 CTST
Theo Rutherford – Bohr, nguyên tử có cấu tạo như thế nào?
Trả lời:
Theo Rutherford – Bohr, nguyên tử gồm hạt nhân ở bên trong và vỏ:
- Vỏ nguyên tử: Gồm các electron (e) mang điện tích âm được sắp xếp thành từng lớp và chuyển động xung quanh hạt nhân.
- Hạt nhân nguyên tử: Gồm các proton (p) mang điện tích dương.
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân và phân bố theo từng lớp với số lượng electron nhất định trên mỗi lớp ở vỏ nguyên tử. Lớp đầu tiên gần sát hạt nhân chứa tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron,…Các electron được sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết. Trong nguyên tử, số hạt proton và electron luôn bằng nhau.
Câu 4 trang 15 SGK Khoa học tự nhiên 7 CTST
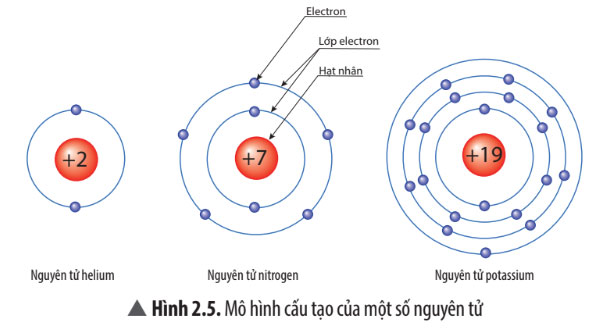
Quan sát Hình 2.5, hãy cho biết nguyên tử nitrogen và potassium có bao nhiêu
a) điện tích hạt nhân nguyên tử?
b) lớp electron?
c) electron trên mỗi lớp?
Trả lời:
- Nguyên tử nitrogen:
+ Điện tích hạt nhân: +7
+ Lớp electron: 2 lớp
+ Số electron trên mỗi lớp: Lớp thứ 1 có 2 electron, lớp thứ 2 có 5 electron.
- Nguyên tử potassium:
+ Điện tích hạt nhân: +19
+ Lớp electron: 4 lớp
+ Số electron: Lớp thứ 1 có 2 electron, lớp thứ 2 có 8 electron, lớp thứ 3 có 8 electron, lớp thứ 4 có 1 electron.
Câu 5 trang 16 SGK Khoa học tự nhiên 7 CTST
Tại sao nguyên tử trung hòa về điện?
Trả lời:
Nguyên tử trung hoà về điện vì trong mỗi nguyên tử, số hạt proton (+) và electron (-) luôn bằng nhau.
Câu hỏi củng cố trang 16 SGK Khoa học tự nhiên 7 CTST
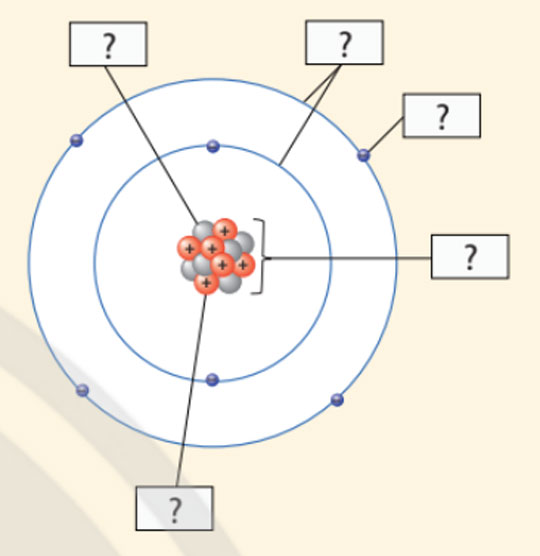
- Cho biết các thành phần cấu tạo nên nguyên tử trong hình minh họa sau:
- Quan sát Hình 2.6, hãy hoàn thành bảng sau:
| Số đơn vị điện tích hạt nhân | Số proton | Số electron trong nguyên tử | Số electron ở lớp ngoài cùng |
| ? | ? | ? | ? |
Để lớp electron ngoài cùng của nguyên tử oxygen có đủ số electron tối đa thì cần thêm bao nhiêu electron nữa?
Trả lời:
- Các thành phần cấu tạo nên nguyên tử trong hình minh họa đã cho là:
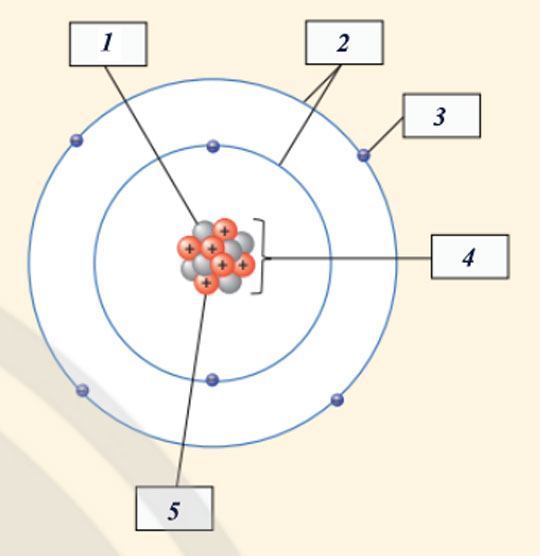
(1) Neutron
(2) Vỏ nguyên tử
(3) Electron
(4) Hạt nhân nguyên tử
(5) Proton
Nguyên tử oxygen có 8 electron
| Số đơn vị điện tích hạt nhân | Số proton | Số electron trong nguyên tử | Số electron ở lớp ngoài cùng |
| 8 | 8 | 8 | 6 |
Để lớp electron ngoài cùng của nguyên tử oxygen có đủ số electron tối đa là 8 thì cần thêm 2 electron nữa.
2. KHỐI LƯỢNG NGUYÊN TỬ
Câu 6 trang 17 SGK Khoa học tự nhiên 7 CTST
Vì sao người ta thường sử dụng amu làm đơn vị khối lượng nguyên tử?
Trả lời:
Người ta thường dùng amu làm đơn vị khối lượng nguyên tử vì:
- Khối lượng nguyên tử bằng tổng khối lượng các loại hạt và khối lượng này là rất nhỏ.
- Phải sử dụng đơn vị khối lượng nguyên tử (amu) để biểu thị:
1 amu = 1,9926 x 10-23 gam
Câu hỏi củng cố trang 17 SGK Khoa học tự nhiên 7 CTST
Quan sát mô hình dưới đây, cho biết số proton, số electron và xác định khối lượng nguyên tử magnesium (biết số neutron = 12).
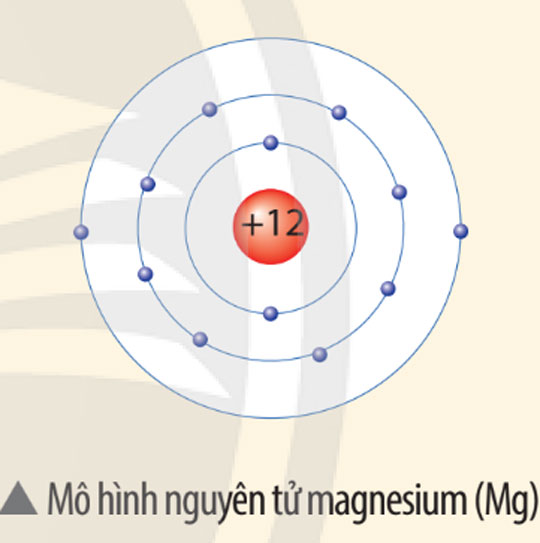
Trả lời:
Một nguyên tử magnesium (Mg) gồm: 12 proton, 12 electron.
=> Khối lượng nguyên tử Mg bằng 12 + 12 = 24 amu.
GIẢI KHTN 7 CHÂN TRỜI SÁNG TẠO BÀI 2 PHẦN BÀI TẬP
Câu 1 trang 17 SGK Khoa học tự nhiên 7 CTST
Em hãy điền vào chỗ trống các từ, cụm từ thích hợp sau để được câu hoàn chỉnh:
| chuyển động | các electron | hạt nhân | điện tích dương | trung hòa về điện |
| vỏ nguyên tử | điện tích âm | vô cùng nhỏ | sắp xếp |
Nguyên tử là hạt...(1) và (2)... Theo Rutherford – Bohr, nguyên tử có cấu tạo gồm 2 phần là (3)... (mang (4)...) và (5)... tạo bởi (6)... (mang (7)...)
Trong nguyên tử, các electron (8)... xung quanh hạt nhân và (9)... thành từng lớp
Trả lời:
Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Theo Rutherford – Bohr, nguyên tử có cấu tạo gồm 2 phần là hạt nhân (mang điện tích dương) và vỏ nguyên tử tạo bởi các electron (mang điện tích âm)
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân và sắp xếp thành từng lớp
Câu 2 trang 17 SGK Khoa học tự nhiên 7 CTST
Vì sao nói khối lượng hạt nhân được coi là khối lượng nguyên tử?
Trả lời:
Proton và neutron có khối lượng xấp xỉ bằng nhau (gần bằng 1 amu). Electron có khối lượng rất bé (chỉ khoảng bằng 0,00055 amu), nhỏ hơn rất nhiều lần so với khối lượng của proton và neutron. Do đó khối lượng hạt nhân được coi là khối lượng nguyên tử.

0 Comments:
Đăng nhận xét