LT Bài 5: Tính theo phương trình hoá học\
Câu 1: Cho sơ đồ phản ứng sau:
$Al + HCl − → AlCl_3 + H_2$
Sau phản ứng thu được 7,437 lít (đkc) khí hydrogen thì số mol của Al đã tham gia phản ứng là
- 0,3 mol.
- 0,1 mol.
- 0,2 mol.
- 0,15 mol.
Số mol khí hydrogen là: ${n_{H_2}} = \Large{\frac{7,437}{ 24,79}}$ = 0,3 ( m o l )
PTHH:$2Al + 6HCl → 2AlCl_3 + 3H_2$
Tỉ lệ phản ứng:23 Đề bài:0,2←0,3(mol)
Số mol của Al đã tham gia phản ứng là 0,2 mol.
- 0,3 mol.
- 0,1 mol.
- 0,2 mol.
- 0,15 mol.
Số mol khí hydrogen là: ${n_{H_2}} = \Large{\frac{7,437}{ 24,79}}$ = 0,3 ( m o l )
PTHH:$2Al + 6HCl → 2AlCl_3 + 3H_2$
Tỉ lệ phản ứng:23 Đề bài:0,2←0,3(mol)
Số mol của Al đã tham gia phản ứng là 0,2 mol.
Câu 2: Cho phương trình hóa học nhiệt phân muối calcium carbonate:
Số mol CaCO3 cần dùng để điều chế được 0,2 mol CaO là
- 0,3 mol.
- 0,1 mol.
- 0,2 mol.
- 0,4 mol.
PTHH: $C a C O _3 (t^o) → C a O + C O_ 2$ .
Tỉ lệ phản ứng:11
Đề bài:0,2 ← 0,2(mol)
Vậy số mol $CaCO_3$ cần dùng để điều chế được 0,2 mol CaO là 0,2 mol.
- 0,3 mol.
- 0,1 mol.
- 0,2 mol.
- 0,4 mol.
PTHH: $C a C O _3 (t^o) → C a O + C O_ 2$ .
Tỉ lệ phản ứng:11
Đề bài:0,2 ← 0,2(mol)
Vậy số mol $CaCO_3$ cần dùng để điều chế được 0,2 mol CaO là 0,2 mol.
Câu 3: Một nhà máy dự tính sản xuất 100 tấn $NH_3$ từ $N_2$ và $H_2$trong điều kiện thích hợp. Tuy nhiên, khi đưa vào quy trình sản xuất thực tế chỉ thu được 25 tấn $NH_3$. Hiệu suất của phản ứng sản xuất $NH_3$ nói trên là
- 4,0% gam.
- 40%.
- 25,0%.
- 2,5 %.
Hiệu suất phản ứng là H = $\Large{\frac{m_{N H_3t t}} {m_{N H_3 l t}}}$ × 100 % = 25 100 × 100 % = 25 %
- 4,0% gam.
- 40%.
- 25,0%.
- 2,5 %.
Hiệu suất phản ứng là H = $\Large{\frac{m_{N H_3t t}} {m_{N H_3 l t}}}$ × 100 % = 25 100 × 100 % = 25 %
Câu 4: Cho phương trình hóa học sau: $2 K M n O _4 (t^ o) → K _2 M n O _4 + M n O_ 2 + O_ 2 ↑$ . Thể tích khí $O_2$ (đkc) thu được khi nhiệt phân hoàn toàn 1 mol $KMnO_4$ là
- 24,79 lít.
- 49,58 lít.
- 12,395 lít.
- 11,2 lít.
PTHH: $2K MnO_4 (t^ o) → K_2MnO_4 + MnO_2 + O_2 ↑ $ .
Tỉ lệ phản ứng: 21
Đề bài:1← 0,5(mol).
Số mol oxygen thu được là 0,5 mol
Thể tích khí $O_2$ (đkc) thu được là: 0,5.24,79 = 12,395 (lít).
- 24,79 lít.
- 49,58 lít.
- 12,395 lít.
- 11,2 lít.
PTHH: $2K MnO_4 (t^ o) → K_2MnO_4 + MnO_2 + O_2 ↑ $ .
Tỉ lệ phản ứng: 21
Đề bài:1← 0,5(mol).
Số mol oxygen thu được là 0,5 mol
Thể tích khí $O_2$ (đkc) thu được là: 0,5.24,79 = 12,395 (lít).
Câu 5: Một nhà máy dự tính sản xuất 80 tấn vôi sống CaO từ đá vôi. Tuy nhiên, khi đưa vào quy trình sản xuất thực tế chỉ thu được 25 tấn CaO. Hiệu suất của quá trình nói trên là
- 32,0%.
- 25,0% gam.
- 30,5 %.
- 31,25%.
Hiệu suất phản ứng là
H = $\Large{\frac{m_{CaOtt}}{ m_{CaOlt}}}$ × 100 % = 25 80 × 100 % = 31,25 %
- 32,0%.
- 25,0% gam.
- 30,5 %.
- 31,25%.
Hiệu suất phản ứng là
H = $\Large{\frac{m_{CaOtt}}{ m_{CaOlt}}}$ × 100 % = 25 80 × 100 % = 31,25 %
Câu 6:Cho phương trình hóa học sau:
Số mol Fe cần dùng để điều chế được 2 mol iron(III) chloride là
- 4 mol.
- 2 mol.
- 3 mol.
- 1 mol.
PTHH:
Tỉ lệ phản ứng: 22
Đề bài: 2←2(mol)
Vậy số mol Fe cần dùng là 2 mol.
- 4 mol.
- 2 mol.
- 3 mol.
- 1 mol.
PTHH:
Tỉ lệ phản ứng: 22
Đề bài: 2←2(mol)
Vậy số mol Fe cần dùng là 2 mol.
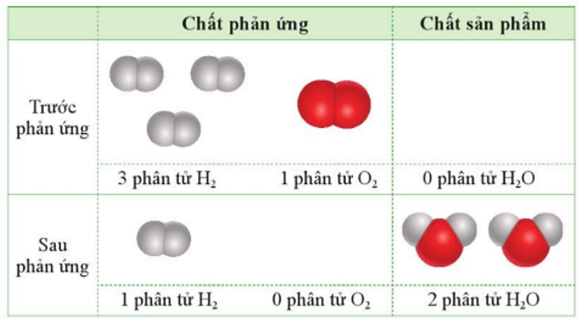
Câu 7:Cho 3 phân tử H2 tác dụng với 1 phân tử O2 (trong điều kiện thích hợp):
- Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử $H_2$ dư.
- Sau khi phản ứng xảy ra hoàn toàn, chỉ thu được 2 phân tử nước, không còn phân tử $H_2$ và $O_2$.
- Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử $O_2$ dư.
- Sau khi phản ứng xảy ra hoàn toàn, thu được 1 phân tử nước và còn 1 phân tử $H_2$ dư.
Phát biểu đúng là “Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử $H_2$ dư”.
Câu 8:Đốt 32,0 gam sulfur trong khí oxygen dư, tính khối lượng $SO_2$ thu được nếu hiệu suất phản ứng đạt 80%.
- 64 gam.
- 80 gam.
- 52,1 gam.
- 51,2 gam.
Số mol sulfur tham gia phản ứng là:
80
100
×
32
=
25,6
(
g
)
PTHH: $S + O_2 → SO_2$
Tỉ lệ phản ứng:11
Đề bài:0,8 → 0,8 (mol)
Vậy khối lượng $SO_2$ thu được là: 0,8 × 64 = 51,2 (gam).
Câu 9: Cho kim loại sắt tác dụng với dung dịch $H_SO_4$ loãng, thu được $FeSO_4$ và khí hydrogen. Nếu dùng 5,6 gam sắt thì số mol $H_2SO_4$ cần để phản ứng là bao nhiêu?
- 0,1 mol.
- 0,3 mol.
- 1 mol.
- 0,2 mol.
Số mol sắt là:
n
F
e
=
5,6
56
=
0,1
(
m
o
l
)
.
PTHH: $Fe + H_2SO_4 → FeSO_4 + H_2$
Tỉ lệ phản ứng:1 →1
Đề bài:0,1 →0,1(mol)
Vậy số mol $H_2SO_4$ cần dùng là 0,1 (mol).
Câu 10: Cho sơ đồ phản ứng sau:
$Zn + HCl ZnCl_2 + H_2$
Sau phản ứng thu được 7,437 lít (đkc) khí hydrogen thì khối lượng của Zn đã tham gia phản ứng là
- 13,0 gam.
- 15,9 gam.
- 26,0 gam.
- 19,5 gam.
Số mol $H_2$ thu được là: $n_{H_2}$ =
7,437
24,79
=
0,3
(
m
o
l
)
Số mol $H_2$ thu được là:
PTHH: $Zn + 2HCl → ZnCl_2 + H_2$
Tỉ lệ phản ứng:11
Đề bài:0,3←0,3 (mol)
Vậy khối lượng của Zn là 0,3×65 = 19,5 gam.
Câu 11: Nếu đốt 12,0 gam carbon trong khí oxygen dư thu được 39,6 gam $CO_2$ thì hiệu suất phản ứng là
- 80%.
- 85%.
- 90%..
- 95%.
PTHH: $C + O_2 → CO_2$
Tỉ lệ phản ứng:11
Đề bài:0,9←0,9(mol)
Hiệu suất phản ứng là
H
= $\Large{\frac{n_{C
t
t}} {n_{C
l
t}}}$ ×
100
%
=
0,9
1
×
100
%
=
90
%
Câu 12: Trộn 4 gam bột sulfur với 14 gam bột sắt rồi nung nóng trong điều kiện không có không khí. Khối lượng FeS thu được sau phản ứng là
- 18 gam.
- 16 gam.
- 13 gam.
- 11,0 gam.
$n_S
= \frac{m}{M}$ =
4
32
=
0,125
(
m
o
l
)
$n
Fe
=\frac{ m}{M}$ =
14
56
=
0,25
(
m
o
l
)
$Fe+S (t^0) →
FeS$
Tỉ lệ phản ứng:
111
(mol)
Đề bài:
0,250,125
(mol)
Tỉ lệ: $\frac{0,25}{1} > \frac{0,125}{1}$
Fe dư S hết
Phản ứng:
0,125
→
0,125
(mol)
$m_{FeS}$ = n.M = 0,125.88 = 11,0 (g)
Câu 13: Đốt cháy hoàn toàn 7,5 gram than đá (biết than đá có thành phần chính là carbon, chứa 4% tạp chất không cháy) thu được $CO_2$. Thể tích khí oxi cần dùng (đkc) để đốt cháy hết lượng than đá trên là
- 14,874 lít.
- 15,29 lít.
- 67,2 lít.
- 33,6 lít.
Khối lượng carbon nguyên chất trong 7,5 gram than đá là:
$ m_C$ =
7,5
.
100
−
4
100
=
7,2
(
gam
)
$ C + O_2
→
CO_24$
Tỉ lệ phản ứng:
1 1
(mol)
Phản ứng: 0,6
→
0,6
(mol)
⇒ $V_{O_2} =
n_{O_2}$ .24,79
=
14,874
(
lit
)
Câu 14: Cho hỗn hợp X (chứa 2,3 gam sodium và 1,95 gam potassium) tác dụng hết với nước, thu được khí hydrogen và dung dịch chứa NaOH và KOH. Thể tích khí hydrogen thu được (đkc) là
- 3,7185 lít.
- 1,85925 lít.
- 2,6848 lít.
- 1,7353 lít.
$2Na+ 2H+2O (t^ 0) →
2NaOH+H_2$
Tỉ lệ phản ứng:
21
(mol)
Phản ứng:
0,1
→
0,05
(mol)
$2K+2H_2O (t^ 0) →
2KOH+H_2$
Tỉ lệ phản ứng: 21
(mol)
Phản ứng: 0,05
→
0,025
(mol)
⇒ $n_{H_2}$ =
0,05
+
0,025
=
0,075
(
m
o
l
)
⇒ $V_{H_2} =
n_{O_2}$ .24,79
=
0,075.24,79
=
1,85925
(
l
i
t
)

0 Comments:
Đăng nhận xét