1. Lý thuyết cần nắm vững:
- Hiđro có tính khử, có thể tác dụng với một số oxit kim loại ở nhiệt độ cao.
Ví dụ:
H2 + CuO (đen) 
3H2 + Fe2O3 
- H2 không tác dụng với các oxit: Na2O, K2O, BaO, CaO, MgO, Al2O3.
2. Các bước giải:
+ Tính số mol các chất đã cho
+ Viết phương trình hóa học, cân bằng phản ứng.
+ Xác định chất dư, chất hết (nếu có), tính toán theo chất hết, (nếu oxit còn dư thì chất rắn sau phản ứng gồm oxit dư và kim loại tạo thành)
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài.
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích.
- Áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm
- Nếu bài cho số liệu số mol cả chất tham gia phản ứng và chất sản phẩm thì tính toán theo chất sản phẩm.
B. Ví dụ minh họa
Ví dụ 1: Khử hoàn toàn 24 gam đồng (II) oxit bằng khí hiđro. Hãy:
a. Tính số gam đồng kim loại thu được;
b. Tính thể tích khí hiđro (đktc) cần dùng.
Lời giải:
Số mol CuO: nCuO = 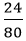
H2 + CuO 
a. Theo phương trình, nCu = nCuO = 0,3 mol
Khối lượng đồng kim loại thu được: mCu = nCu.MCu = 0,3.64 = 19,2 gam
b. Theo phương trình, nH2 = nCuO = 0,3 mol
Thể tích khí hiđro cần dùng ở đktc là: VH2 = 22,4.nH2 = 22,4.0,3 = 6,72 lít.
Ví dụ 2: Trong phòng thí nghiệm người ta dùng hiđro để khử sắt (III) oxit và thu được 11,2 g sắt.
a) Viết phương trình hóa học của các phản ứng đã xảy ra
b) Tính khối lượng sắt (III) oxit đã phản ứng.
Lời giải:
a) Phương trình phản ứng hóa học:
Fe2O3 + 3H2 
b) Số mol sắt thu được: nFe = 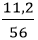
Fe2O3 + 3H2 
0,1 ← 0,2 (mol)
Khối lượng oxit sắt tham gia phản ứng:
mFe2O3 = nFe2O3 . MFe2O3 = 0,1.(56.2+16.3) = 16 gam.
Ví dụ 3: Khử hoàn toàn 8 gam một oxit của kim loại R (có hoá trị II) cần vừa đủ 2,24 lít H2 (đktc). Xác định kim loại R?
Lời giải:
Gọi công thức của oxit là RO (vì R có hóa trị II)
nH2 = 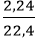
Phương trình hóa học:
RO + H2 
0,1 ← 0,1 (mol)
Khối lượng của oxit: mRO = nRO.MRO = 0,1.(MR +16) = 8 gam
→ MR +16 = 80 → MR = 64 (g/mol).
Vậy kim loại cần tìm là đồng (kí hiệu hóa học: Cu).
Ví dụ 4: Khử 48 gam đồng(II) oxit bằng khí hiđro thì khối lượng kim loại đồng thu được là
A. 38,4 gam.
B. 44,8 gam.
C. 48 gam.
D. 51,2 gam.
Hướng dẫn giải:
nCuO = 48 : (64 + 16) = 0,6 mol.
Phương trình phản ứng:
Vậy khối lượng kim loại đồng là 0,6.64 = 38,4 gam.
Đáp án A
Ví dụ 5: Cho 21,7 gam thủy ngân(II) oxit tác dụng với khí hiđro. Thể tích khí hiđro cần dùng là bao nhiêu?
A. 0,336 lít.
B. 1,792 lít.
C. 2,24 lít.
D. 3,36 lít.
Hướng dẫn giải:
nHgO = 21,7 : (201 + 16) = 0,1 mol
Ta có phương trình phản ứng là
Suy ra thể tích hiđro cần dùng là: 0,1.22,4 = 2,24 lít.
Đáp án C
Ví dụ 6: Khử hoàn toàn 8 gam một oxit của kim loại A (có hóa trị II) cần vừa đủ 2,24 lít H2 (đktc). Xác định kim loại A?
A. Fe.
B. Mg.
C. Hg.
D. Cu.
Hướng dẫn giải:
Gọi công thức của oxit là AO (do A có hóa trị II)
n hiđro = 2,24 : 22,4 = 0,1 mol
Phương trình phản ứng:
Khối lượng của oxit là 0,1.(MA + 16) = 8 gam
Suy ra MA + 16 = 80 và MA = 64 (g/mol)
Vậy A là Cu
Đáp án D
C. Bài tập vận dụng
Câu 1: Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. Oxit nào không bị hiđro khử?
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Lời giải:
Đáp án D
H2 không tác dụng với các oxit: Na2O, K2O, CaO...
Câu 2: Trong những oxit sau: CuO, MgO, Al2O3, Ag2O, Na2O, PbO. Có bao nhiêu oxit phản ứng với hiđro ở nhiệt độ cao?
A. 4
B. 5
C. 3
D. 1
Lời giải:
Đáp án C
- H2 không tác dụng với các oxit: Na2O, K2O, BaO, CaO, MgO, Al2O3
→ Những oxit phản ứng với hiđro ở nhiệt độ cao là: CuO, Ag2O, PbO.
Câu 3: Sau phản ứng của CuO với H2 thì có hiện tượng gì?
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam.
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ.
C. Có chất khí bay lên.
D. Không có hiện tượng.
Lời giải:
Đáp án B
H2 + CuO (đen) 
Câu 4: Một sản phẩm thu được sau khi dẫn khí hiđro qua chì (II) oxit nung nóng là
A. Pb
B. H2
C. PbO
D. Không phản ứng
Lời giải:
Đáp án A
H2 + PbO 
Câu 5: Tính thể tích hiđro (đktc) cần dùng để điều chế 5,6 gam Fe từ FeO?
A. 2,24 lít.
B. 1,12 lít.
C. 3,36 lít.
D. 4,48 lít.
Lời giải:
Đáp án A
nFe = 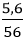
Phương trình hóa học:
FeO + H2 
0,1 ← 0,1 (mol)
Thể tích hiđro cần dùng là: VH2 = 22,4.nH2 = 0,1.22,4 = 2,24 lít
Câu 6: Cho CuO tác dụng hết với 1,12 lít khí H2 ở nhiệt độ cao. Sau phản ứng thấy có m gam kim loại. Giá trị của m là:
A. 6,4 gam
B. 3,2 gam
C. 0,72 gam
D. 7,2 gam
Lời giải:
Đáp án B
nH2 = 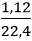
H2 + CuO 
0,05 → 0,05 (mol)
mCu = nCu.MCu = 0,05.64 = 3,2 gam
Câu 7: Người ta điều chế 24 gam đồng bằng cách dùng H2 khử CuO. Khối lượng CuO bị khử là:
A. 15 gam
B. 45 gam
C. 60 gam
D. 30 gam
Lời giải:
Đáp án D
nCu = 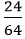
H2 + CuO 
0,375 ← 0,375 (mol)
Khối lượng CuO bị khử là:
mCuO = nCuO.MCuO = 0,375.(64+16) = 30 gam
Câu 8: Cho khí H2 tác dụng với Fe2O3 nung nóng thu được 11,2g Fe. Thể tích khí H2 (đktc) đã tham gia phản ứng là:
A. 1,12lít
B. 2,24 lít
C. 6,72 lít
D. 4,48 lít
Lời giải:
Đáp án C
nFe = 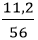
3H2 + Fe2O3 
0,3 ← 0,2 (mol)
Thể tích khí H2 đã tham gia phản ứng là:
VH2 = 22,4.nH2 = 22,4.0,3 = 6,72 lít
Câu 9: Khử 48 gam đồng (II) oxit bằng khí hiđro cho 36,48 gam đồng. Hiệu suất của phản ứng là:
A. 90%
B. 95%
C. 94%
D. 85%
Lời giải:
Đáp án B
nCuO = 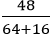
H2 + CuO 
0,6 → 0,6 (mol)
Khối lượng đồng kim loại thu được theo lý thuyết là:
mCu lt = nCu.MCu = 0,6.64 = 38,4 gam
Hiệu suất của phản ứng là: H = 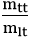
Câu 10: Khử hoàn toàn 12 gam sắt (III) oxit bằng khí hiđro. Thể tích khí hiđro (đktc) cần dùng là:
A. 5,04 lít
B. 7,56 lít
C. 10,08 lít
D. 8,2 lít
Lời giải:
Đáp án A
nFe2O3 = 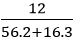
3H2 + Fe2O3 
0,225 ← 0,075 (mol)
Thể tích khí H2 cần dùng là:
VH2 = 22,4.nH2 = 22,4.0,225 = 5,04 lít
Câu 11: Chất rắn Cu tạo thành từ phản ứng của CuO và H2 có màu gì?
A. Màu đen.
B. Màu nâu.
C. Màu xanh.
D. Màu đỏ.
Hướng dẫn giải:
H2 tác dụng với CuO ở nhiệt độ cao sinh ra Cu. Kim loại Cu có màu đỏ.
Đáp án D
Câu 12: Trong những oxit sau: CuO, MgO, Al2O3, Ag2O, FeO, Na2O. Ở nhiệt độ cao H2 khử được bao nhiêu oxit kim loại trên?
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải:
Ở nhiệt độ cao, H2 khử được các oxit CuO, Ag2O, FeO trong dãy.
Đáp án B
Câu 13: Trong những oxit sau: CuO, NO, Fe2O3, Na2O, CaO. Oxit nào không bị hiđro khử?
A. NO, CaO, Na2O.
B. CuO, NO, Fe2O3.
C. Fe2O3, Na2O, CaO.
D. NO, Fe2O3, Na2O.
Hướng dẫn giải:
H2 không tác dụng với các oxit sau: NO, CaO, Na2O.
Đáp án A
Câu 14: Khử hoàn toàn 16 gam sắt(III) oxit bằng khí hiđro. Thể tích khí hiđro (đktc) cần dùng là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
Hướng dẫn giải:
Ta có phương trình phản ứng:
Vậy thể tích khí hiđro cần dùng là 0,3.22,4 = 6,72 lít.
Đáp án D
Câu 15: Khử 24 gam đồng(II) oxit bằng khí hiđro thu được 12,8 gam đồng. Hiệu suất của phản ứng là
A. 50%.
B. 60%.
C. 66,67%.
D. 85%.
Hướng dẫn giải:
Phương trình phản ứng:
Suy ra hiệu suất của phản ứng là
Đáp án C
Câu 16: Người ta điều chế 24 gam đồng bằng cách cho H2 tác dụng với CuO. Khối lương CuO bị khử là
A. 15 gam.
B. 30 gam.
C. 45 gam.
D. 60 gam.
Hướng dẫn giải:
nCu = 24 : 64 = 0,375 mol
Phương trình phản ứng:
Khối lượng CuO là: 0,375.(64 + 16) = 30 gam
Đáp án B
Câu 17: Cho khí H2 tác dụng với FeO nung nóng thu được 11,2 gam Fe. Thể tích khí H2 (đktc) đã tham gia phản ứng là
A. 1,12 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 6,72 lít.
Hướng dẫn giải:
nFe = 11,2 : 56 = 0,2 mol
Phương trình phản ứng:
Vậy thể tích H2 là: 0,2.22,4 = 4,48 lít.
Đáp án C
Câu 18: Cho CuO tác dụng hết với 11,2 lít khí H2 ở nhiệt độ cao. Sau phản ứng thấy có m gam kim loại. Giá trị của m là:
A. 16 gam
B. 32 gam
C. 72 gam
D. 64 gam
Hướng dẫn giải:
Phương trình phản ứng:
Suy ra khối lượng đồng là 0,5.64 = 32 gam
Đáp án B
Câu 19: Tính thể tích hiđro (đktc) cần dùng để điều chế 5,6 gam Fe từ FeO ?
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải:
nFe = 5,6 : 56 = 0,1 mol
Phương trình hóa học:
Thể tích H2 là 0,1. 22,4 = 2,24 lít
Đáp án B
Câu 20: Một sản phẩm thu được sau khi dẫn khí hiđro qua chì(II) oxit nung nóng là
A. Pb
B. H2
C. PbO
D. Không phản ứng
Hướng dẫn giải:

0 Comments:
Đăng nhận xét