A. Lý thuyết & Phương pháp giải
I. Sự khử và sự oxi hóa
1. Sự khử
- Là sự tách oxi ra khỏi hợp chất
Ví dụ: CuO + H2 
Trong phương trình hóa học trên, ta thấy H2 đã kết hợp với nguyên tố oxi tạo thành H2O, hay H2 chiếm oxi của CuO.
2. Sự oxi hóa
- Sự oxi hóa là sự tác dụng của oxi với một chất.
Ví dụ: 2Zn + O2 
II. Chất khử và chất oxi hóa
- Chất khử là chất chiếm oxi của chất khác.
- Chất oxi hóa là đơn chất oxi hoặc chất nhường oxi cho chất khác.
Ví dụ: trong phương trình hóa học: CuO + H2 
- CuO nhường oxi cho H2 tạo thành Cu nên CuO là chất oxi hóa
- H2 chiếm oxi của CuO tạo thành H2O nên H2 là chất khử
III. Phản ứng oxi hóa - khử
- Phản ứng oxi hóa – khử là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
Các bước giải toán:
+ Tính số mol các chất đã cho
+ Viết phương trình hóa học
+ Xác định chất dư, chất hết (nếu có), tính toán theo chất hết
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích
- Áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm
- Nếu bài cho số liệu số mol cả chất tham gia phản ứng và chất sản phẩm thì tính toán theo chất sản phẩm.
B. Ví dụ minh họa
Ví dụ 1: Cho các phản ứng sau, những phản ứng nào là phản ứng oxi hóa – khử?
S + O2 
CaCO3 
2H2 + O2 
NH3 + HCl → NH4Cl (4)
Lời giải:
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử. Những phản ứng oxi hóa – khử là:
S + O2 
2H2 + O2 
Ví dụ 2: Hãy lập các phương trình hóa học theo các sơ đồ sau:
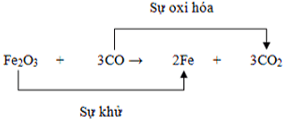
Fe2O3 + CO → CO2 + Fe (1)
Fe3O4 + H2 → H2O + Fe (2)
CO2 + Mg → MgO + C (3)
Các phản ứng hóa học này có phải ứng oxi hóa – khử không? Vì sao?
Lời giải:
Fe2O3 + 3CO 
Fe3O4 + 4H2 
CO2 + 2Mg 2MgO + C 
Các phản ứng trên thuộc loại phản ứng oxi hóa - khử.
Ví dụ 3: Trong phòng thí nghiệm người ta dùng hiđro để khử sắt (III) oxit và thu được 11,2 g sắt.
a) Viết phương trình hóa học của các phản ứng đã xảy ra
b) Tính khối lượng sắt (III) oxit đã phản ứng.
Lời giải:
a) Phương trình phản ứng hóa học:
Fe2O3 + 3H2 
b) Số mol sắt thu được: nFe = 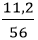
Fe2O3 + 3H2 
0,1 ← 0,2 (mol)
Khối lượng oxit sắt tham gia phản ứng:
mFe2O3 = nFe2O3 . MFe2O3 = 0,1 . (56 . 2 + 16 . 3) = 16 gam
C. Bài tập vận dụng
Câu 1: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. CuO + 2HCl → CuCl2 + H2O
B. CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
C. 3Fe + 2O2 
D. FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Lời giải:
Đáp án C
Phản ứng oxi hóa – khử là: 3Fe + 2O2 
Trong đó Fe là chất khử, O2 là chất oxi hóa
Câu 2: Cho phản ứng sau: Fe2O3 + 3H2 
A. Fe2O3
B. H2
C. Fe
D. H2O
Lời giải:
Đáp án B
Chất khử là chất lấy oxi của chất khác. Trong phản ứng này, H2 là chất lấy oxi của Fe2O3 nên H2 là chất khử.
Câu 3: Chọn đáp án đúng:
A. Sự tách oxi khỏi hợp chất được gọi là sự oxi hóa.
B. Sự tác dụng của oxi với một chất gọi là sự khử.
C. Chất khử là chất chiếm oxi của chất khác.
D. Chất oxi hóa là chất chiếm oxi của chất khác.
Lời giải:
Đáp án C
Chất khử là chất chiếm oxi của chất khác
Câu 4: Oxit nào bị khử bởi hiđro?
A. Na2O
B. CaO
C. Fe3O4
D. BaO
Lời giải:
Đáp án C
Oxit bị khử là Fe3O4
Phương trình hóa học: Fe3O4 + 4H2 
Câu 5: Phản ứng nào không phải phản ứng oxi hóa – khử:
A. 4Na + O2 
B. Fe3O4 + 4H2 
C. NH3 + HCl → NH4Cl
D. 2CO + O2 
Lời giải:
Đáp án C
Phản ứng nào không phải phản ứng oxi hóa – khử là:
NH3 + HCl → NH4Cl (không có sự khử và sự oxi hóa trong phản ứng)
Câu 6: Kim loại luôn đóng vai trò là chất gì trong phản ứng oxi hóa – khử?
A. chất oxi hóa.
B. chất khử.
C. chất xúc tác.
D. chất môi trường.
Lời giải:
Đáp án B
Kim loại luôn đóng vai trò là chất khử trong phản ứng oxi hóa – khử
Câu 7: Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Tính số gam oxi cần dùng để điều chế được 2,32 gam oxit sắt từ ?
A. 0,64 gam
B. 0,32 gam
C. 0,16 gam
D. 1,6 gam
Lời giải:
Đáp án A
nFe3O4 = 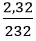
Phương trình hóa học:
3Fe + 2O2 
0,02 ← 0,01(mol)
nO2 = 0,02 mol; Số gam oxi: mO2 = 32 . 0,02 = 0,64g.
Câu 8: Đốt cháy hết 2,7 gam bột nhôm trong không khí thu được 5,1 gam nhôm oxit. Tính khối lượng oxi đã tham gia phản ứng?
A. 2,7 gam
B. 5,4 gam
C. 2,4 gam
D. 3,2 gam
Lời giải:
Đáp án C
3O2 + 4Al 
Áp dụng định luật bảo toàn khối lượng:
mAl + mO2 = mAl2O3
mO2 = 5,1 - 2,7 = 2,4g
Câu 9: Đốt cháy 3,1 gam photpho trong bình chứa oxi dư tạo ra điphotpho pentaoxit. Tính khối lượng oxit thu được sau phản ứng?
A. 1,45 gam
B. 14,20 gam
C. 1,42 gam
D. 7,10 gam
Lời giải:
Đáp án D
nP = 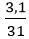
4P + 5O2 
0,1 → 0,05 (mol)
mP2O5 = 0,05 . 142 = 7,1 gam
Câu 10: Người ta điều chế 24 gam đồng bằng cách dùng H2 khử CuO. Khối lượng CuO bị khử là:
A. 15 gam
B. 45 gam
C. 60 gam
D. 30 gam
Lời giải:
Đáp án D
nCu = 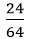
H2 + CuO 
0,375 ← 0,375 (mol)
Khối lượng CuO bị khử là:
mCuO = nCuO.MCuO = 0,375 . (64 + 16) = 30 gam
D. Bài tập thêm
Câu 1: Trong các phản ứng hóa học sau, phản ứng không phải phản ứng oxi hóa -khử là
A.
B. AgNO3 + HCl → AgCl + HNO3
C. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
D.
Câu 2: Đốt cháy hoàn toàn 4,8 gam bột than trong không khí. Thể tích khí thu được (đkc) sau phản ứng là
A. 8,96 lít.
B. 9,916 lít.
C. 0,9916 lít.
D. 0,48 lít.
Câu 3: Người ta điều chế được 64 gam Cu bằng cách dùng H2 khử copper(II) oxide. Khối lượng copper(II) oxide bị khử là
A. 70 gam.
B. 75 gam.
C. 40 gam.
D. 80 gam.
Câu 4: Dùng khí H2 để khử hỗn hợp gồm CuO và Fe2O3 trong đó Fe2O3 chiếm 80% khối lượng hỗn hợp. Thể tích khí H2 ở đkc cần dùng là
A. 24,79 lít.
B. 19,2125 lít.
C. 21,69125 lít.
D. 19,46015 lít.
Câu 5: Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxygen, sau phản ứng sản phẩm là Al2O3. Giá trị của a là
A. 21,6.
B. 16,2.
C. 18,0.
D. 27,0.

0 Comments:
Đăng nhận xét