A. Lý thuyết & Phương pháp giải
- Ở nhiệt độ cao, oxi có thể tác dụng với hầu hết các kim loại để tạo ra các oxit (trừ một số kim loại như: vàng (Au) hay bạch kim (Pt)…).
Ví dụ:
2O2 + 3Fe 
O2 + 2Mg 
3O2 + 4Al 
- Các bước giải:
+ Tính số mol các chất đã cho.
+ Viết phương trình hóa học.
+ Xác định chất dư, chất hết (nếu có) rồi tính toán theo chất hết.
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài.
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích.
- Áp dụng định luật bảo toàn khối lượng: mKL + mO2 = moxit
- Nếu bài cho số liệu số mol cả chất tham gia phản ứng và chất sản phẩm thì tính toán theo chất sản phẩm.
B. Ví dụ minh họa
Ví dụ 1: Đốt cháy hoàn toàn 25,2 g sắt trong bình chứa khí O2.
a) Hãy viết phương trình phản ứng xảy ra.
b) Tính thể tích khí O2 (ở đktc) đã tham gia phản ứng trên.
Lời giải:
a) Phương trình hóa học:
2O2 + 3Fe 
0,3 ← 0,45 (mol)
b) Ta có: nFe = 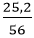
Theo phương trình, tính được nO2 = 0,3 mol
VO2 = 0,3.22,4 = 6,72 lít.
Ví dụ 2: Cho 13,5g kim loại nhôm tác dụng với 8,96 lít khí oxi ở đktc.
a) Viết PTHH xảy ra?
b) Tính khối lượng oxit thu được sau khi phản ứng kết thúc?
Lời giải:
a) Phương trình hóa học:
4Al + 3O2 
b) nAl = 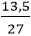
nO2 = 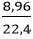
Ta có: 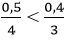
4Al + 3O2 
0,5 → 0,25(mol)
mAl2O3 = 0,25.102 = 25,5 gam.
Ví dụ 3: Đốt cháy hoàn toàn 5,6g Fe. Sau phản ứng thu được 8g một oxit. Xác định công thức phân tử oxit sắt thu được?
Lời giải:
nFe = 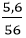
Theo định luật bảo toàn khối lượng: mFe + mO2 = moxit
→ 5,6 + mO2 = 8
mO2 = 2,4g → nO2 = 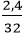
Bảo toàn nguyên tố O có: nO = 2. mO2 = 0,15 mol.
Đặt oxit: FexOy
→ x : y = nFe : nO = 0,1 : 0,15 = 2 : 3
Công thức phân tử của oxit là Fe2O3.
C. Bài tập vận dụng
Câu 1: Nhôm cháy trong oxi tạo ra nhôm oxit Al2O3. Khi đốt cháy 54 gam nhôm trong oxi dư thì tạo ra số mol Al2O3 là
A. 0,5 mol.
B. 0,75 mol.
C. 1 mol.
D. 1,5 mol.
Lời giải:
Đáp án C.
nAl = 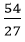
4Al + 3O2 
2 →1 (mol)
Vậy nAl2O3 = 1mol.
Câu 2: Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Tính số gam oxi cần dùng để điều chế được 2,32g oxit sắt từ?
A.0,64 gam.
B. 0,32 gam.
C.0,16 gam.
D. 1,6 gam.
Lời giải:
Đáp án A.
nFe3O4 = 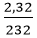
Phương trình hóa học:
3Fe + 2O2 
0,02 ← 0,01(mol)
nO2 = 0,02 mol; Số gam oxi: mO2 = 32.0,02 = 0,64g.
Câu 3: Đốt cháy hết 2,7g bột nhôm trong không khí thu được 5,1g nhôm oxit. Tính khối lượng oxi đã tham gia phản ứng?
A. 2,7g.
B. 5,4g.
C. 2,4g.
D. 3,2g.
Lời giải:
Đáp án C
3O2 + 4Al 
Áp dụng định luật bảo toàn khối lượng:
mAl + mO2 = mAl2O3
mO2 = 5,1-2,7 = 2,4g.
Câu 4: Cho 5,4 gam Al tác dụng vừa đủ với oxi thu được nhôm oxit Al2O3. Tính khối lượng Al2O3 tạo thành.
A. 5,1g.
B. 10,2g.
C. 1,2g.
D. 20,4g.
Lời giải:
Đáp án B.
Số mol Al: nAl = 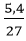
Phương trình hóa học:
4Al + 3O2 
0,2 → 0,1 (mol)
Khối lượng Al2O3 tạo thành: mAl2O3 = 0,1 . 102 = 10,2 g
Câu 5: Đốt cháy 1mol sắt trong oxi thu được 1mol sắt oxit. Công thức của oxit sắt này là:
A. FeO
B. Fe2O3
C. Fe3O4
D. Fe3O2
Lời giải:
Đáp án A.
1mol Fe → 1 mol oxit sắt
Suy ra trong oxit chỉ có chứa 1 nguyên tử Fe.
Vậy công thức của oxit đó là: FeO.
Câu 6: Trong hợp chất oxit của kim loại A hóa trị I thì oxi chiếm 17,02% theo khối lượng. Kim loại A là?
A. Li.
B. Zn.
C. K.
D. Na.
Lời giải:
Đáp án C.
Công thức oxit của kim loại A là A2O
Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng:
Ta có: 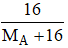
Vậy A là kim loại kali (K)
Câu 7: Để oxi hóa hoàn toàn một kim loại R thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. R là kim loại nào sau đây?
A. Fe.
B. Al.
C. Mg.
D. Ca.
Lời giải:
Đáp án D
Gọi nguyên tử khối của kim loại R là R và có hóa trị là x (x = 1, 2, 3, 4)
4R + xO2 
4 → x → 2 mol
Theo đề bài ta có: mO2 = 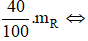
=> MR = 20x
| x | 1 | 2 | 3 |
| MR | 20 (loại) | 40 (Canxi) | 60 (loại) |
Vậy R là Canxi (Ca).
Câu 8: Đốt cháy hoàn toàn 1,35 g nhôm trong khí oxi. Khối lượng nhôm oxit thu được và khối lượng oxi đã tham gia phản ứng lần lượt là
A. 2,25g và 1,2g.
B. 2,55g và 1,28g.
C. 2,55 và 1,2g.
D. 2,7 và 3,2 g.
Lời giải:
Đáp án C
PTHH: 4Al + 3O2 
Tỉ lệ: 4 ....... 3 ....... 2
Pứ: 0,05 ....... ? ....... ?mol
Theo PTHH: nO2 = 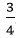
nAl2O3 = 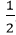
Câu 9: Đốt cháy m gam kim loại magie (Mg) trong không khí thu được 8g MgO. Biết rằng khối lượng Mg tham gia phản ứng bằng 1,5 lần khối lượng của oxi (không khí) tham gia phản ứng. Tính khối lượng của Mg và khí oxi đã phản ứng.
A. 2,4g và 1,6g.
B. 4,8g và 1,6g.
C. 2,4 và 3,2g.
D. 4,8 và 3,2 g.
Lời giải:
Đáp án D.
2Mg + O2 
Gọi khối lượng Oxi là a (g) → khối lượng Mg là 1,5a (g)
Theo định luật BTKL ta có 1,5a + a = 8 (g)
→ a = 3,2g
→ Khối lượng Mg là 3,2 . 1,5 = 4,8g.
Câu 10: Đốt cháy hoàn toàn 7,5 gam hỗn hợp gồm hai kim loại là Al và Mg thấy thu được 13,1 gam hỗn hợp các oxit. Khối lượng oxi tham gia phản ứng là
A. 5,6 gam.
B. 6,5 gam.
C. 2,8 gam.
D. 6,4 gam.
Lời giải:
Đáp án A
Áp dụng định luật bảo toàn khối lượng ta có: mhỗn hợp KL + mO2 = mhh oxit
D. Bài tập thêm
Câu 1: Oxi hoá hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxide. Giá trị của m là
A. 7,4.
B. 8,7.
C. 9,1.
D. 10.
Câu 2: Đốt cháy hoàn toàn 13 gam một kim loại hóa trị II trong oxygen dư đến khối lượng không đổi thu được 16,2 gam chất rắn X. Kim loại đó là
A. Zn.
B. Fe.
C. Cu.
D. Ca.
Câu 3: Đốt cháy 6,5 gam Zn trong 2,479 lít khí oxygen ở đkc. Thu được a gam ZnO. Giá trị của a là
A. 9,1.
B. 9,2.
C. 8,1.
D. 8,4.
Câu 4: Đốt cháy a gam hỗn hợp A gồm Fe và Mg trong 9,916 lít oxygen ở đkc, sau phản ứng thu được 16,2 gam hỗn hợp oxide B gồm Fe3O4 và MgO. Giá trị của a là
A. 3,4.
B. 4,3.
C. 5,2.
D. 4,5.
Câu 5: Để oxi hóa hoàn toàn 3,24 gam một kim loại R thì cần vừa đủ 2,2311 lít khí oxygen (đkc). Kim loại R là
A. Fe.
B. Cu.
C. Zn.
D. Al.

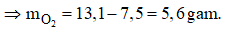
0 Comments:
Đăng nhận xét