1. Điều chế oxi trong phòng thí nghiệm
- Trong phòng thí nghiệm, oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và kém bền với nhiệt như KMnO4, KClO3, ...
+ Điều chế Oxi từ nguyên liệu là kali pemanganat KMnO4
2KMnO4 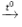
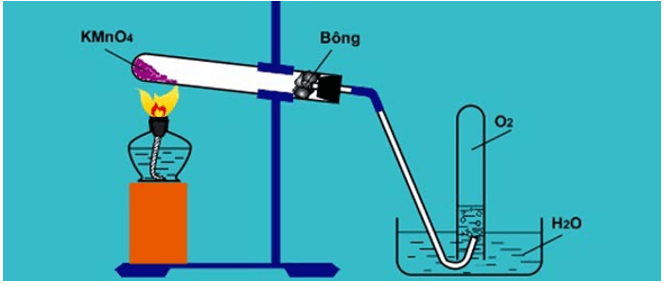
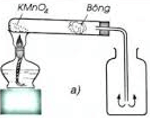
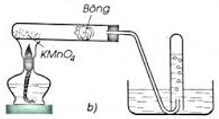
Hình minh họa điều chế O2 trong phòng thí nghiệm từ KMnO4.
+ Điều chế Oxi bằng từ nguyên liệu là kali clorat KClO3
2KClO3 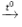
Thông thường nếu điều chế O2 từ KClO3 có dùng thêm chất xúc tác là MnO2. Do đó phản ứng hóa học có thể viết:
2KClO3 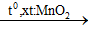
* Cách thu khí oxi:
Do oxi nặng hơn không khí và ít tan trong nước nên có thể thu khí oxi vào ống nghiệm hay lọ bằng hai cách:
a) đẩy không khí.
b) đẩy nước.
II. Sản xuất Oxi (O2) trong công nghiệp
Nguyên liệu để sản xuất khí oxi trong công nghiệp là không khí hoặc nước.
1. Sản xuất khí oxi từ không khí.
- Trước hết hoá lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lòng bay hơi, đầu tiên thu được khí N2 (-196oC) sau đó là khí Oxi (-183oC).
2. Sản xuất khí oxi từ nước.
- Điện phân nước trong các bình điện phân, thu được 2 chất khí riêng biệt là Oxi và Hiđro
2H2O 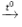
- Khí Oxi dùng trong công nghiệp thường được hoá lỏng và được nén dưới áp suất cao trong các bình thép.
- Thu khí oxi vào lọ hoặc ống nghiệm bằng hai cách:
+ Cách 1: bằng cách đẩy không khí
+ Cách 2: bằng cách đẩy nước
2. Điều chế oxi trong công nghiệp
Trong công nghiệp, oxi được sản xuất từ không khí (chưng cất phân đoạn không khí lỏng) và từ nước (điện phân nước).
Lưu ý: Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
B. Ví dụ minh họa
Ví dụ 1: Tính số gam kali clorat cần thiết để điều chế 33,6g khí oxi.
Hướng dẫn giải
Số mol oxi là: 1,05 mol
2KClO3 2KCl + 3O2
0,7 1,05 (mol)
Theo phương trình phản ứng ta có: = 0,7 mol
Vậy khối lượng của kali clorat cần tìm là: 0,7.122,5 = 85,75 g.
Ví dụ 2: Nhiệt phân hoàn toàn 4,74 g KMnO4 thu được V lít khí oxi ở đktc. Tính giá trị của V.
Hướng dẫn giải
Số mol của KMnO4 là: 0,03 mol
2KMnO4 K2MnO4 + MnO2 + O2
0,03 0,015 (mol)
Theo phương trinh phản ứng ta có số mol oxi là 0,015 mol
Vậy thể tích khí oxi là V = 0,015.22,4 = 0,336 lít.
Ví dụ 3: Cho sơ đồ phản ứng: KClO3 ---> KCl + O2
Tính tổng hệ số sản phẩm trong phản ứng trên.
Hướng dẫn giải
Phương trình phản ứng: 2KClO3 2KCl + 3O2
Các chất sản phẩm trong phản ứng trên là: KCl, O2
Vậy tổng hệ số sản phẩm trong phản ứng trên là: 2 + 3 = 5
Ví dụ 4: Nhiệt phân hoàn toàn 24,5 gam KClO3 sau phản ứng thấy thoát ra V lít khí oxi (đktc). Tính giá trị của V ?
Lời giải:
nKClO3 = 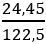
2KClO3 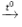
0,2 → 0,3 (mol)
nO2 = 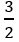
Vậy VO2 = 0,3.22,4 = 6,72 lít
Ví dụ 5: Khi nung nóng kali pemanganat (KMnO4) tạo thành Kali manganat (K2MnO4), mangan đioxit (MnO2) và khí oxi.
a. Hãy viết phương trình hóa học của phản ứng
b. Tính khối lượng kali pemanganat cần lấy để điều chế được 33,6 lít khí oxi (đktc).
Lời giải:
a. Phương trình hóa học:
2KMnO4 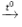
b. nO2 = 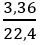
2KMnO4 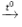
0,3 ← 0,15 (mol)
Theo phương trình: nKMnO4 = 2nO2 = 0,3 mol
mKMnO4 = 0,3.158 = 47,4 gam.
Ví dụ 6: Nếu lấy 2 chất kali pemanganat (KMnO4) và Kali clorat (KClO3) với khối lượng bằng nhau để điều chế oxi. Chất nào cho thể tích oxi nhiều hơn.
Lời giải:
MKClO3 = 122,5 g/mol ; MKMnO4 = 158 g/mol
Giả sử ta lấy cùng một khối lượng là a gam
nKClO3 = 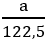
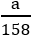
2KClO3 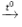
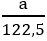

2KMnO4 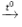
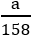
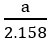
So sánh: 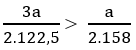
Vậy khi nhiệt phân cùng một lượng KClO3 sinh ra nhiều khí oxi hơn
C. Bài tập tự luyện
Câu 1: Trong công nghiệp oxi được điều chế bằng cách:
A. Quang hợp
B. Bay hơi nước
C. Lên men rượu
D. Chưng cất phân đoạn không khi lỏng
Đáp án: Chọn D
Câu 2: Nhiệt phân hoàn toàn 12,25 g KClO3 sau phản ứng thu được m (g) khí oxi. Giá trị của m là
A. 4,6 g
B. 6,4 g
C. 8,4 g
D. 4,8 g
Đáp án: Chọn D
Số mol KClO3 là: 0,1 mol
2KClO3 2KCl + 3O2
0,1 0,15 (mol)
Vậy khối lượng của O2 là: m = 0,15.32 = 4,8 g.
Câu 3: Trong phòng thí nghiệm người ta điều chế oxi bằng nguyên liệu nào?
A. KMnO4
B. CaCO3
C. BaCO3
D. Không khí
Đáp án: Chọn A
Câu 4: Cho phương trình phản ứng: 2KMnO4 K2MnO4 + MnO2 + O2
Hãy cho biết tích hệ số các chất sản phẩm là bao nhiêu?
A. 1
B. 2
C. 3
D. 4
Đáp án: Chọn A
Các chất sản phẩm: K2MnO4, MnO2, O2
Vậy tích hệ số các chất sản phẩm là: 1.1.1 = 1
Câu 5: Đâu là phản ứng điều chế oxi trong phòng thí nghiệm
A. CaCO3 CaO + CO2
B. 4P + 5O2 2P2O5
C. 2KClO3 2KCl + 3O2
D. Cu(OH)2 CuO + H2O
Đáp án: Chọn C
Câu 6: Nhiệt phân hoàn toàn a g KMnO4 thu được 8,96 lít khí oxi ở đktc. Giá trị của a là
A. 116,4 g
B. 1,264 g
C. 126,4 g
D. 12,64 g
Đáp án: Chọn C
Số mol oxi là: 0,4 mol
2KMnO4 K2MnO4 + MnO2 + O2
0,8 0,4 (mol)
Theo phương trình phản ứng, ta có = 0,8 mol
Vậy khối lượng của KMnO4 là: m = 0,8.158 = 126,4 g.
Câu 7: Trong công nghiệp, O2 được sản xuất bằng nguyên liệu nào?
A. không khí
B. KClO3
C. BaCO3
D. KMnO4
Đáp án: Chọn A
Câu 8: Trong các phát biểu sau:
(1) Trong phòng thí nghiệm người ta điều chế oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao.
(2) Có 2 cách thu khí oxi là: đẩy không khí và đẩy nước.
(3) Trong công nghiệp người ta điều chế oxi từ KMnO4
(4) Nguyên liệu để sản xuất khí oxi trong công nghiệp là không khí hoặc nước.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Đáp án: Chọn C
Câu 9: Để thu khí oxi bằng cách đẩy không khí nhờ vào tính chất là
A. khí oxi tan ít trong nước
B. khí oxi nhẹ hơn không khí
C. khí oxi nặng bằng không khí
D. khí oxi nặng hơn không khí
Đáp án: Chọn D
Câu 10: Sự khác nhau về cách điều chế oxi trong công nghiệp và trong phòng thì nghiêm là về:
A. Nguyên liệu
B. Giá thành
C. Sản lượng
D. Cả A, B, C đều đúng
Đáp án: Chọn A
Câu 11: Người ta thu được khí oxi bằng cách đẩy nước nhờ vào tính chất nào?
A. Khí oxi tan trong nước.
B. Khí oxi ít tan trong nước.
C. Khí oxi khó hóa lỏng.
D. Khí oxi nhẹ hơn nước.
Lời giải:
Đáp án B
Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất: Khí oxi ít tan trong nước.
Câu 12: Người ta thu được khí oxi bằng cách đẩy không khí nhờ vào tính chất nào?
A. Khí oxi nhẹ hơn không khí.
B. Khí oxi nặng hơn không khí.
C. Khí oxi dễ trộn lẫn với không khí.
D. Khí oxi ít tan trong nước.
Lời giải:
Đáp án B
Người ta thu khí oxi bằng cách đẩy không khí nhờ dựa vào tính chất: khí oxi nặng hơn không khí
Câu 13: Nguyên liệu để sản xuất O2 trong công nghiệp là phương án nào sau đây?
A. KMnO4
B. KClO3
C. KNO3
D. Không khí
Lời giải:
Đáp án D
Nguyên liệu để sản xuất O2 trong công nghiệp là: không khí
Sản xuất khí oxi từ không khí bằng cách hạ không khí xuống dưới -200oC, sau đó nâng dần nhiệt độ lên -196oC ta thu được khí N2, sau đó nâng đến -183oC ta thu được khí oxi.
Câu 14: Các chất dùng để điều chế khí Oxi trong phòng thí nghiệm là:
A. KClO3
B. KMnO4
C. CaCO3
D. Cả A và B
Lời giải:
Đáp án D
Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao như KMnO4 và KClO3.
Câu 15: Nhiệt phân 12,25 g KClO3 thu được khí oxi. Tính thể tích của khí thu được ở đktc là:
A. 4,8 lít
B. 3,36 lít
C. 2,24 lít
D. 3,2 lít
Lời giải:
Đáp án B
nKClO3 = 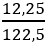
2KClO3 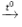
0,1 → 0,15 (mol)
Vậy VO2 = 0,15.22,4 = 3,36 lít
Câu 16: Cho phản ứng 2KMnO4 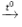
Tổng hệ số cân bằng của các chất sản phẩm là:
A. 3
B. 2
C. 1
D. 5
Lời giải:
Đáp án A
2KMnO4 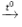
Tổng hệ số sản phẩm 1 + 1 + 1 = 3
Câu 17: Tính khối lượng KMnO4 để điều chế được 2,7552 lít khí oxi (đktc).
A. 38,678 g
B. 38,868 g
C. 37,689 g
D. 38,886 g
Lời giải:
Đáp án B
nO2 = 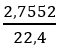
2KMnO4 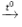
0,246 ← 0,123 (mol)
mKMnO4 = 0,246.158 = 38,868 gam.
Câu 18: Không dùng cách nào sau đây để điều chế oxi trong phòng thí nghiệm?
A. Đun nóng KMnO4.
B. Đung nóng KClO3 với xúc tác MnO2.
C. Phân hủy H2O2.
D. Chưng cất phân đoạn không khí lỏng.
Lời giải:
Đáp án D
Chưng cất phân đoạn không khí lỏng dùng sản xuất O2 trong công nghiệp.
Câu 19: Nhiệt phân hoàn toàn 31,6 gam KMnO4, thu được V lít O2 (đktc). Giá trị của V là
A. 2,24 lít
B. 1,12 lít
C. 4,48 lít
D. 8,96 lít
Lời giải:
Đáp án A
nKMnO4 = 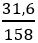
2KMnO4 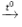
0,2 → 0,1 (mol)
⇒ VO2 = 0,1.22,4 = 2,24 (lít)
Câu 20: Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. KMnO4.
B. NaHCO3.
C. (NH4)2SO4.
D. CaCO3.
Lời giải:
Đáp án A
Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao như KMnO4 và KClO3.
2KMnO4 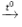

0 Comments:
Đăng nhận xét