I. Mol
Mol là lượng chất có chứa 6,022 × 1023 nguyên tử hay phân tử của chất đó.
Số 6,022 × 1023 gọi là số Avogadro và được kí hiệu là N.
Ví dụ:
1 mol nguyên tử Fe có chứa 6,022 × 1023 nguyên tử Fe.
1 mol phân tử NaCl có chứa 6,022 × 1023 phân tử NaCl.
II. Khối lượng mol
1. Khái niệm
Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của 1 mol chất đó. Đơn vị khối lượng mol là gam/mol (hay gam.mol-1).
Ví dụ:
Khối lượng mol nguyên tử Cu là 64 gam/mol.
Khối lượng mol phân tử nước là 18 gam/mol.
2. Chuyển đổi giữa số mol và khối lượng
Gọi
- n là số mol chất (mol)
$n=\frac{m}{M}$
- M là khối lượng mol của chất (gam/mol)
$M = \frac{m}{n}$
- m là khối lượng chất (gam)
$m = n \times {M}$
Công thức chuyển đổi :
III. Thể tích mol chất khí
1. Khái niệm
Một mol bất kì khí nào, trong cùng điều kiện nhiệt độ và áp suất đều chiếm những thể tích bằng nhau, người ta gọi đó là thể tích mol chất khí.
Định luật Avogadro: Trong cùng điều kiện nhiệt độ và áp suất, các khí có cùng thể tích sẽ chứa cùng số mol.
Ở điều kiện chuẩn (đkc) áp suất 1 bar, nhiệt độ 25oC thì 1 mol bất kì khí nào cũng đều chiếm thể tích 24,79 lít.
Ví dụ: Thể tích 1 mol khí O2 cũng như 1 mol khí N2 ở điều kiện chuẩn đều là 24,79 lít.
2. Chuyển đổi giữa số mol và thể tích
Gọi n là số mol chất khí (mol), V là thể tích của chất khí ở đkc (lít), ta có công thức chuyển đổi sau:
IV. Tỉ khối của chất khí
Tỉ khối của chất khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B.
Trong đó:
dA/B là tỉ khối của khí A đối với khí B.
MA, MB là khối lượng mol của khí A và khí B (gam/mol).

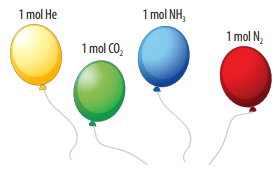
0 Comments:
Đăng nhận xét