Giới thiệu về liên kết hóa học: Liên kết ion, liên kết cộng hóa trị
Lý thuyết: Giới thiệu về liên kết hóa học
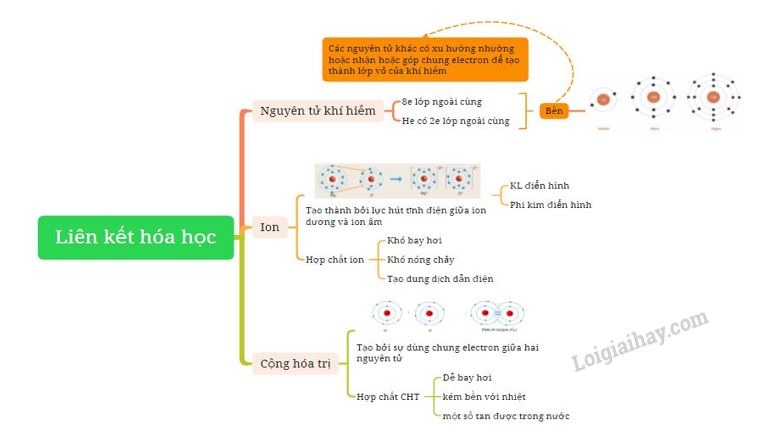
1. Vỏ nguyên tử khí hiếm
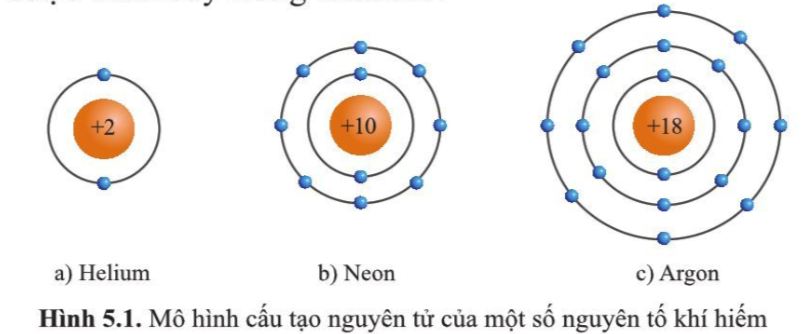
- Nguyên tử khí hiếm có 8 electron ở lớp vỏ ngoài cùng (trừ He có 2 electron) và là lớp vỏ bền vững
=> Các nguyên tử khí hiếm không tham gia liên kết ở điều kiện thường
- Các nguyên tử khác có lớp vỏ ngoài cùng kém bền có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác
2. Liên kết ion
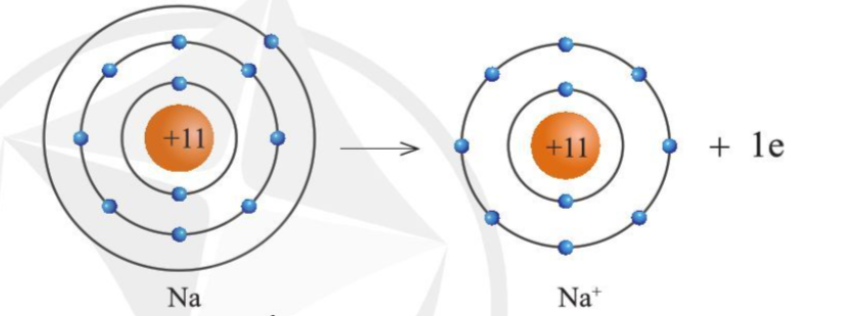
Sự tạo thành ion dương
- Các nguyên tử của nguyên tố kim loại thường có xu hướng nhường electron ở lớp ngoài cùng để tạo thành cấu hình của khí hiếm
- Nguyên tử kim loại khi nhường electron sẽ tạo thành ion dương tương ứng
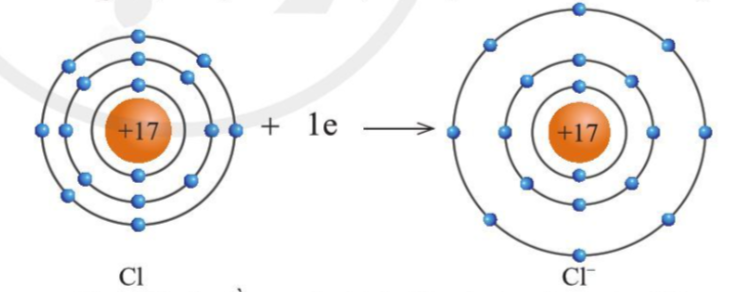
Sự tạo thành ion âm
- Các nguyên tử của nguyên tố phi kim thường có xu hướng nhận electron ở lớp ngoài cùng để tạo thành cấu hình của khí hiếm
- Nguyên tử phi kim khi nhận electron sẽ tạo thành ion âm tương ứng
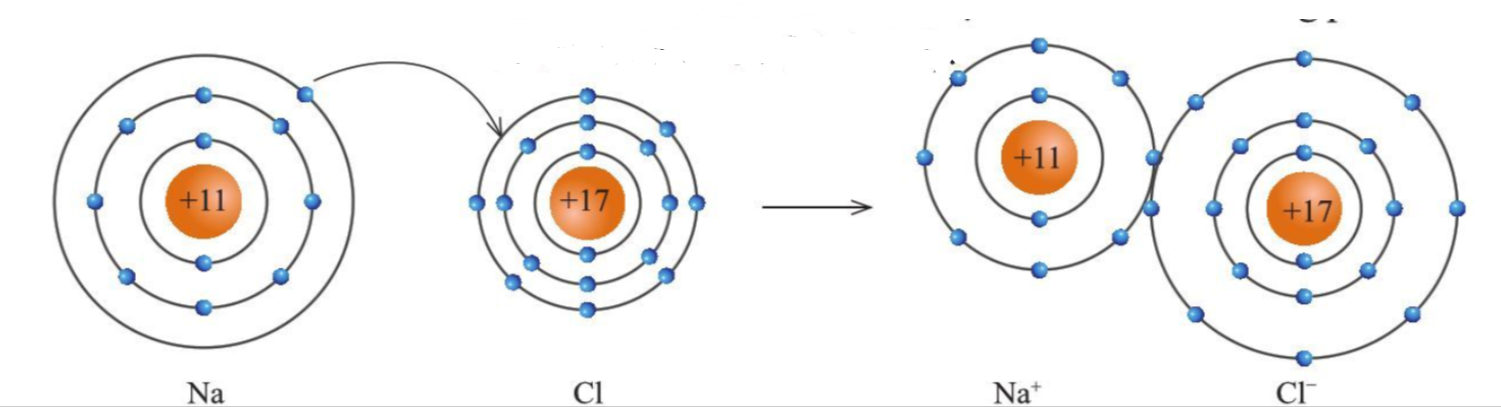
Sự tạo thành liên kết ion
- Ion dương và ion âm mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion

3. Liên kết cộng hóa trị
- Để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất, các nguyên tử của nguyên tố phi kim có xu hướng góp chung electron
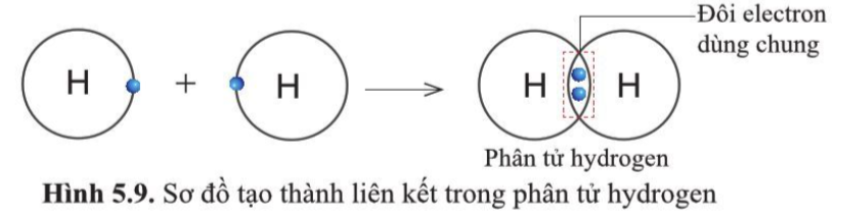
Sự tạo thành liên kết trong phân tử hydrogen
- Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm
=> Khi 2 nguyên tử H liên kết với nhau, mỗi nguyên tử góp 1 electron => đôi electron dùng chung
Sự tạo thành liên kết trong phân tử nước
- Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron
=> 2 cặp electron dùng chung.
=> Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước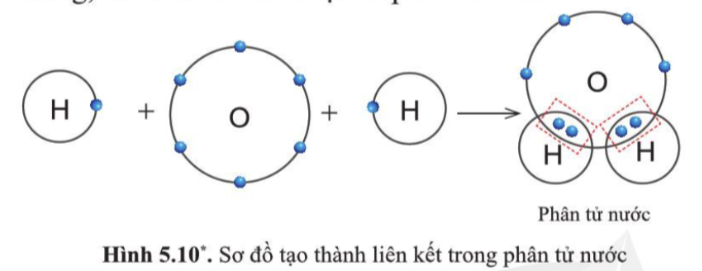
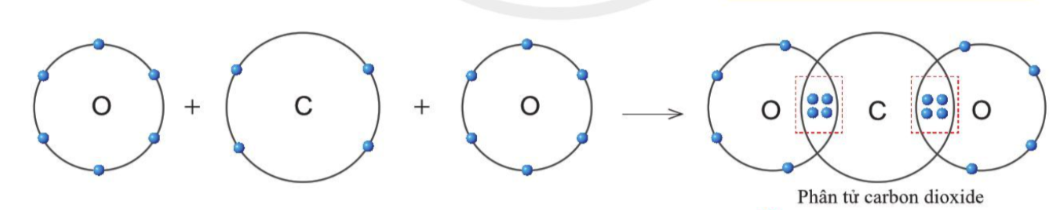
Sự tạo thành liên kết trong phân tử carbon dioxide
- Nguyên tử C có 4 electron ở lớp ngoài cùng và cần thêm 4 electron để đạt được lớp vỏ bền vững
- Trong CO2, nguyên tử C góp 4 electron, mỗi O góp 2 electron
=> Giữa C và O có 2 đôi electron dùng chung

Sơ đồ tư duy:


0 Comments:
Đăng nhận xét